适应症
本品可与其他抗逆转录病毒(s)联合使用,用于治疗因耐药性、耐受性或安全性考虑而未能采用当前抗逆转录病毒方案的感染人类免疫缺陷病毒1型(HIV-1)的成人患者。
用法用量
1.推荐剂量
可以使用以下两种推荐剂量方案中的一种
2.漏用剂量
在维持治疗期间,如果自末次注射以来已经超过28周,且临床指征提示患者适合继续治疗,则从第1天开始重新开始按照起始剂量方案进行治疗,可选方案1或方案2。
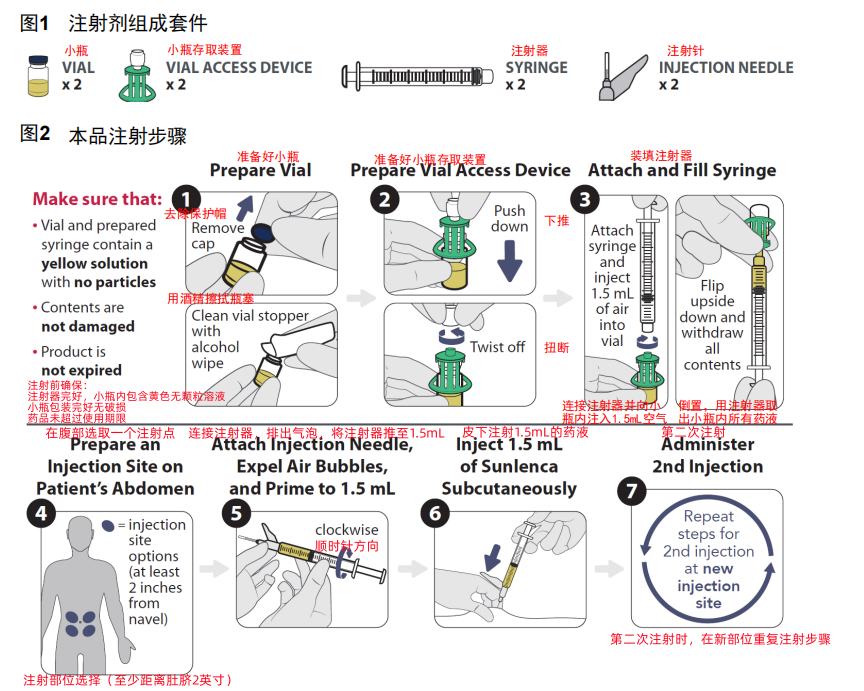
3.本品注射剂注射器组成和使用步骤
本品注射剂注射器组成和使用步骤请见下述图1和图2。
不良反应
最常见的不良反应(任何级别、发生率≥3%)包括恶心和注射部位反应。
禁忌
与强CYP3A诱导剂联合给药会导致本品浓度降低,这可能导致疗效丧失和产生耐药性。
贮存方法
在20℃至25℃室温下,遮光、密封、干燥处保存。
适用人群
成人。妊娠期、哺乳期、儿童及老人请在医师指导下使用。
药物相互作用
1.其他药物对本品的影响
本品是P-gp、UGT1A1和CYP3A的底物。
(1)强或中度CYP3A诱导剂
CYP3A强诱导剂或中度诱导剂的药物可显著降低本品的血浆浓度,可能导致其疗效丧失,产生耐药性,因此在本品治疗期间,禁止其与强CYP3A诱导剂联合用药,并且在本品治疗期间不建议联合使用中度CYP3A诱导剂。
(2)联合P-gp、UGT1A1和强CYP3A抑制剂
联合P-gp、UGT1A1和强CYP3A抑制剂,可能会显著增加本品血浆浓度,不建议本品与这些抑制剂联合用药。
2.本品对其他药物的影响
本品是CYP3A的中度抑制剂,由于其皮下给药后半衰期较长,本品可能会增加在末次皮下给药后9个月内开始接触的主要由CYP3A代谢的药物暴露量,这可能会增加不良反应的潜在风险,因此请参阅敏感CYP3A底物的处方信息,获取CYP3A抑制剂的推荐剂量。
3.已知和本品有潜在的重要相互作用的药物
有效期
24个月
剂型
片剂
生产厂家
美国吉利德
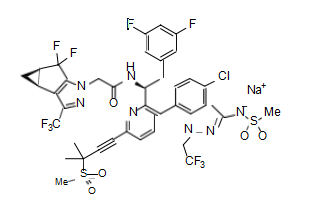
成分
本品的主要活性成分为lenacapavir
其化学结构如下:
性状
薄膜涂衣片剂
注意事项
1.免疫重建综合征
(1)在联合抗逆转录病毒治疗的初始阶段,出现免疫系统反应的患者可能会对惰性或残留的机会性感染产生炎症反应,这可能需要进一步的评估和治疗。
(2)免疫免疫疾病(如格雷夫斯病、多发性肌炎、格林-巴雷综合征和自身免疫性肝炎)也发生在免疫重建的环境中,但发病时间多变,可能在开始治疗几个月后发生。
2.与本品相关的长效性能和潜在的相关风险
(1)本品的残留浓度可能会在患者的体循环中留存较长时间(在最后一次皮下注射后的12个月或更长时间),建议患者按时注射本品,接受每6个月的维持治疗,因为错过剂量或不按时注射可能导致丧失病毒学反应和产生耐药性。
(2)本品是一种中度CYP3A抑制剂,可能会增加在末次皮下给药后9个月内开始接触的主要由CYP3A代谢的药物暴露量,这可能会增加不良反应的潜在风险。
(3)如果停用本品,为了减少产生病毒耐药性的潜在风险,必须在本品末次注射后28周内,开始另一种可替代的、完全抑制的抗逆转录病毒方案的治疗,如果在治疗过程中出现病毒学失败,应尽可能让患者改用其他治疗方案。
3.注射部位反应
(1)本品注射液可能导致局部注射部位反应(ISRs),如果发生具有临床显著意义的局部注射部位反应,请对其进行评估并采取适当的治疗和随访。
(2)局部注射部位反应的表现可能包括肿胀、疼痛、红斑、结节、硬化、瘙痒、外渗或肿块,注射部位的结节和硬化可能比其他不良反应需要更长的时间来缓解。
(3)导致部分患者注射部位结节和硬化持续存在的机制尚不完全清楚,但根据现有数据,可能与皮下注射后药物留存有关,在一些接受注射部位结节或硬结皮肤活检的患者中,皮肤病理学显示异物炎症或肉芽肿反应。
(以上参考自FDA美国药监局英国说明书2022.12版)
1.免疫重建综合征
(1)在联合抗逆转录病毒治疗的初始阶段,出现免疫系统反应的患者可能会对惰性或残留的机会性感染产生炎症反应,这可能需要进一步的评估和治疗。
(2)免疫免疫疾病(如格雷夫斯病、多发性肌炎、格林-巴雷综合征和自身免疫性肝炎)也发生在免疫重建的环境中,但发病时间多变,可能在开始治疗几个月后发生。
2.与本品相关的长效性能和潜在的相关风险
(1)本品的残留浓度可能会在患者的体循环中留存较长时间(在最后一次皮下注射后的12个月或更长时间),建议患者按时注射本品,接受每6个月的维持治疗,因为错过剂量或不按时注射可能导致丧失病毒学反应和产生耐药性。
(2)本品是一种中度CYP3A抑制剂,可能会增加在末次皮下给药后9个月内开始接触的主要由CYP3A代谢的药物暴露量,这可能会增加不良反应的潜在风险。
(3)如果停用本品,为了减少产生病毒耐药性的潜在风险,必须在本品末次注射后28周内,开始另一种可替代的、完全抑制的抗逆转录病毒方案的治疗,如果在治疗过程中出现病毒学失败,应尽可能让患者改用其他治疗方案。
3.注射部位反应
(1)本品注射液可能导致局部注射部位反应(ISRs),如果发生具有临床显著意义的局部注射部位反应,请对其进行评估并采取适当的治疗和随访。
(2)局部注射部位反应的表现可能包括肿胀、疼痛、红斑、结节、硬化、瘙痒、外渗或肿块,注射部位的结节和硬化可能比其他不良反应需要更长的时间来缓解。
(3)导致部分患者注射部位结节和硬化持续存在的机制尚不完全清楚,但根据现有数据,可能与皮下注射后药物留存有关,在一些接受注射部位结节或硬结皮肤活检的患者中,皮肤病理学显示异物炎症或肉芽肿反应。
(以上参考自FDA美国药监局英国说明书2022.12版)
1.其他药物对本品的影响
本品是P-gp、UGT1A1和CYP3A的底物。
(1)强或中度CYP3A诱导剂
CYP3A强诱导剂或中度诱导剂的药物可显著降低本品的血浆浓度,可能导致其疗效丧失,产生耐药性,因此在本品治疗期间,禁止其与强CYP3A诱导剂联合用药,并且在本品治疗期间不建议联合使用中度CYP3A诱导剂。
(2)联合P-gp、UGT1A1和强CYP3A抑制剂
联合P-gp、UGT1A1和强CYP3A抑制剂,可能会显著增加本品血浆浓度,不建议本品与这些抑制剂联合用药。
2.本品对其他药物的影响
本品是CYP3A的中度抑制剂,由于其皮下给药后半衰期较长,本品可能会增加在末次皮下给药后9个月内开始接触的主要由CYP3A代谢的药物暴露量,这可能会增加不良反应的潜在风险,因此请参阅敏感CYP3A底物的处方信息,获取CYP3A抑制剂的推荐剂量。
3.已知和本品有潜在的重要相互作用的药物
 全部分类
全部分类





 勒那卡韦 lenacapavir Sunlenca
勒那卡韦 lenacapavir Sunlenca 美国吉利德
美国吉利德 用法用量
用法用量
