【适应症和用途】
ADSTILADRIN是一种基于非复制腺病毒载体的基因疗法,适用于治疗患有高危卡介苗(BCG)无应答的非肌层浸润性膀胱癌(NMIBC)并伴有或不伴有乳头状肿瘤的原位癌(CIS)的成年患者。
【剂量和给药】
• 建议在每次灌注ADSTILADRIN之前预先使用抗胆碱能药物。
• 仅通过膀胱内灌注施用ADSTILADRIN。
• ADSTILADRIN不可用于静脉内使用、局部使用或口服给药。
• 剂量为75mLADSTILADRIN,浓度为3x10¹¹病毒颗粒(vp)/mL,每3个月灌注一次。
• 灌注后将ADSTILADRIN留在膀胱中1小时。
【剂型和强度】
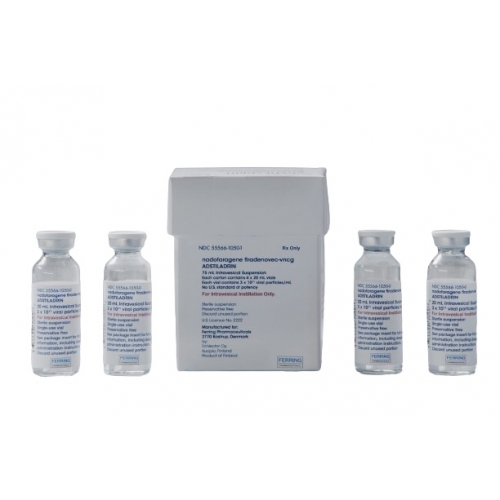
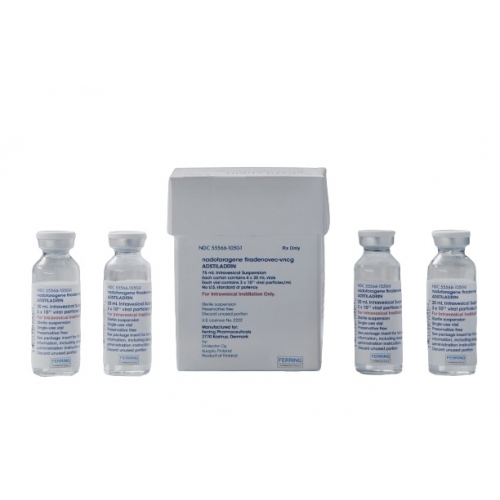
ADSTILADRIN是一种用于膀胱内灌注的混悬液,以一次性小瓶形式提供。
ADSTILADRIN装在一个装有4个小瓶的纸盒中。所有小瓶的标称浓度均为3×10¹¹病毒颗粒(vp)/mL。每瓶ADSTILADRIN的可提取体积不少于20mL。
【禁忌症】
对干扰素α或ADSTILADRIN的任何成分过敏的患者禁用ADSTILADRIN。
【警告和注意事项】
延迟膀胱切除术可能会导致转移性膀胱癌的进展,这可能是致命的。
播散性腺病毒感染的风险:由于具有复制能力的腺病毒水平低,免疫功能低下或免疫缺陷的人可能面临ADSTILADRIN播散性感染的风险。避免将ADSTILADRIN暴露于免疫功能低下或免疫缺陷个体。
【不良反应/副作用】
最常见(>10%)的不良反应,包括实验室异常(>15%),是血糖升高、灌注部位溢液、甘油三酯升高、疲劳、膀胱痉挛、排尿(尿急)、肌酐升高、血尿(尿中带血)、磷酸盐降低、寒意、发热(发烧)和排尿困难(排尿疼痛)。
【在特定人群中使用】
免疫功能低下/免疫缺陷:免疫功能低下或免疫缺陷患者避免使用。
【规格】
每盒包含一个可拆卸的纸板巢,内有4个透明玻璃瓶的ADSTILADRIN。每个小瓶含有可提取体积为20mL的无菌冷冻悬浮液,并用溴丁基橡胶塞和防盗铝卷边密封。
【存储和管理】
ADSTILADRIN在≤-60°C(≤-76°F)的条件下冷冻运输,装在密封后至少可保持所需温度72小时的隔热运输箱中。
患者收到后,ADSTILADRIN纸盒可以按如下所示储存:
• 在≤-60°C(≤-76°F)的冰箱中,直到纸盒上印有的有效期为止。
• 在-25°C至-15°C(-13°F至5°F)的冰箱中保存最多3个月,且不超过小瓶和外盒上印制的原始有效期。当储存在冰箱中时,应注明放置在冰箱中的日期。此外,如果纸盒未被使用,必须在外盒上注明废弃日期。这些日期应该相隔三个月,但不应超过原始到期日期。该报废日期取代了原来的到期日期。
小瓶可在室温下保存长达24小时,或者从冰箱中取出后冷藏。
解冻后,ADSTILADRIN是一种透明至乳白色的悬浮液,标称浓度为3×10¹¹病毒颗粒(vp)/mL。
• 保护小瓶避光。[参见完整处方信息中的‘剂量和给药’]。
• 不要冷冻
• ADSTILADRIN是一种基于非复制腺病毒载体的基因疗法。遵循通用生物安全预防措施进行处理[见完整处方信息中的‘剂量和给药’]。
• 根据适用于处理和处置生物危害废物的当地生物安全指南,处置可能与ADSTILADRIN接触过的未使用产品和一次性材料。
【剂量和给药】
• 建议在每次灌注ADSTILADRIN之前预先使用抗胆碱能药物。
• 仅通过膀胱内灌注施用ADSTILADRIN。
• ADSTILADRIN不可用于静脉内使用、局部使用或口服给药。
• 剂量为75mLADSTILADRIN,浓度为3x10¹¹病毒颗粒(vp)/mL,每3个月灌注一次。
• 灌注后将ADSTILADRIN留在膀胱中1小时。
【剂型和强度】
ADSTILADRIN是一种用于膀胱内灌注的混悬液,以一次性小瓶形式提供。
ADSTILADRIN装在一个装有4个小瓶的纸盒中。所有小瓶的标称浓度均为3×10¹¹病毒颗粒(vp)/mL。每瓶ADSTILADRIN的可提取体积不少于20mL。
 全部分类
全部分类



 Adstiladrin nadofaragene firadenovec-vncg
Adstiladrin nadofaragene firadenovec-vncg 瑞士辉凌医药公司
瑞士辉凌医药公司 用法用量
用法用量